Il veleno è letale da solo – e le frecce – che insieme possono abbattere gli avversari più forti. Scoperto un antibiotico che perfora simultaneamente le pareti batteriche e distrugge il folato all’interno delle loro cellule – uccidendo come una freccia avvelenata – dimostrando al contempo di essere immune alla resistenza agli antibiotici.

Il veleno è letale da solo – come lo sono le frecce – ma la loro combinazione è di maggiore efficacia. Un’arma che attacca simultaneamente dall’interno e dall’esterno può abbattere anche gli avversari più forti, da E. coli a MRSA (Staphylococcus aureus resistente alla meticillina). Un team di ricercatori di Princeton riferisce di aver trovato un composto, SCH-79797, che può contemporaneamente perforare le pareti batteriche e distruggere il folato all’interno delle loro cellule – pur essendo immune alla resistenza agli antibiotici. Le infezioni batteriche sono di due tipi: Gram-positive e Gram-negative – chiamate così per lo scienziato che ha scoperto come distinguerle. La differenza fondamentale è che i batteri Gram-negativi sono corazzati con uno strato esterno che elimina la maggior parte degli antibiotici. Nessuna nuova classe di farmaci che uccidono Gram-negativi è arrivata sul mercato da quasi 30 anni. “Questo è il primo antibiotico in grado di colpire Gram-positivi e Gram-negativi senza resistenza, -ha dichiarato Zemer Gitai, professore di biologia all’ Edwin Grant Conklin– Princeton e autore del documento. “Dal punto di vista del ” perché è utile “, questo è il punto cruciale. Questi scienziati sono più entusiasti di qualcosa che rivela su come funziona questo antibiotico – attaccando attraverso due diversi meccanismi all’interno di una molecola – quindi siamo speranzosi che la speranza sia generalizzabile, portando a migliori antibiotici – e nuovi tipi di antibiotici – in futuro “. La più grande debolezza degli antibiotici è che i batteri si evolvono rapidamente per resistere a loro. Ebbene il team di Princeton ha scoperto che anche con uno sforzo straordinario, non erano in grado di generare alcuna resistenza a questo composto. “Questo è davvero promettente, -ha detto Gitai -, motivo per cui chiamiamo i derivati del composto ‘Irresistin'”. È il Santo Graal della ricerca sugli antibiotici: un antibiotico efficace contro le malattie e immune alla resistenza pur essendo sicuro nell’uomo (a differenza dello sfregamento di alcol o candeggina, irresistibilmente fatali sia per le cellule umane che per le cellule batteriche). “Per un ricercatore di antibiotici, -ha detto James Martin, dottorato di ricerca del 2019- è come scoprire la formula per convertire il piombo in oro o cavalcare un unicorno – qualcosa che tutti vogliono ma nessuno crede davvero che esista”. Martin ha trascorso gran parte della sua carriera di laurea lavorando a questo composto. “La mia prima sfida, – ha poi detto-, è stata convincere il laboratorio che era vero”. L’irresistibilità è un’arma a doppio taglio. La tipica ricerca sugli antibiotici prevede la ricerca di una molecola in grado di uccidere i batteri, l’allevamento di più generazioni fino a quando i batteri non sviluppano resistenza ad essa, osservando come opera esattamente quella resistenza e utilizzandola per decodificare il funzionamento della molecola. SCH-79797 è irresistibile, per cui non c’era nulla da decodificare. “Questa è stata, -rimarca Gitai-, una vera impresa tecnica”. “Nessuna resistenza è un vantaggio dal lato dell’utilizzo, ma una sfida dal lato scientifico.” Il team di ricerca ha affrontato due enormi sfide tecniche: cercare di dimostrare il negativo – cioè nulla può resistere a SCH-79797 – e quindi capire come funziona il composto. Per dimostrare la sua resistenza alla resistenza, Martin ha provato infiniti test e metodi diversi, nessuno dei quali ha rivelato una particella di resistenza al composto SCH. Alla fine, ha provato la forza bruta: per 25 giorni, l’ha “superato in serie”, il che significa che ha esposto i batteri al farmaco ancora e ancora e ancora. Poiché i batteri impiegano circa 20 minuti per generazione, i germi hanno avuto milioni di possibilità di sviluppare resistenza – ma non lo hanno fatto. Per verificare i loro metodi, il team ha anche sottoposto in serie altri antibiotici (novobiocina, trimetoprim, risina e gentamicina) e hanno rapidamente sviluppato resistenza nei loro confronti. Dimostrare un negativo è tecnicamente impossibile, quindi i ricercatori usano frasi come “frequenze di resistenza irrimediabilmente basse” e “nessuna resistenza rilevabile”, ma il risultato è che SCH-79797 è irresistibile – da qui il nome che hanno dato ai suoi composti derivati, Irresistin. Hanno anche provato a usarlo contro le specie batteriche note per la loro resistenza agli antibiotici, tra cui la Neisseria gonorrhoeae, che è nella top 5 delle minacce urgenti pubblicata dal Center for Disease Control and Prevention. “La gonorrea, – ha detto Gitai-, pone un enorme problema rispetto alla resistenza multidroga. Abbiamo esaurito i farmaci per la gonorrea. Con le infezioni più comuni, i farmaci generici della vecchia scuola funzionano ancora. Quando due anni fa mi sono fatto male alla gola, mi è stata somministrata la penicillina-G – la penicillina scoperta nel 1928! Ma per N. gonorrhoeae, i ceppi standard che circolano nei campus universitari sono super resistenti ai farmaci. Quella che era l’ultima linea di difesa, il farmaco di emergenza in caso di emergenza per Neisseria, è ora in prima linea standard di cura. Ecco perché questo è particolarmente importante ed eccitante che potremmo curare “. È stato persino ottenuto un campione del ceppo più resistente di N. gonorrhoeae dalle volte dell’Organizzazione mondiale della sanità – un ceppo resistente a tutti gli antibiotici conosciuti – e “Joe , – ha detto Gitai -, ha mostrato che il nostro ragazzo ha ancora ucciso questo ceppo, con un palese riferimento a Joseph Sheehan, co-primo autore del documento e direttore del laboratorio del Gitai Lab. Per cui siamo piuttosto entusiasti di questo.”
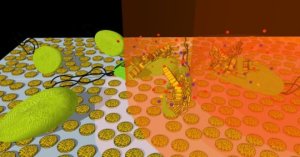
La freccia a punta di veleno Sono stati impiegati anni a cercare di determinare in che modo la molecola uccide i batteri, utilizzando una vasta gamma di approcci, dalle tecniche classiche in circolazione dalla scoperta della penicillina alla tecnologia all’avanguardia. Martin, alla fine, ha rivelato che SCH-79797 utilizza due meccanismi distinti all’interno di una molecola, come una freccia ricoperta di veleno.”La freccia deve essere affilata, – ha detto Benjamin Bratton, associato di biologia molecolare e docente al Lewis Sigler Institute for Integrative Genomics, secondo co-primo autore- per ottenere il veleno, ma anche il veleno deve uccidere da solo”.La freccia prende di mira la membrana esterna – penetrando anche attraverso la spessa armatura di batteri Gram-negativi – mentre il veleno distrugge i folati, elemento fondamentale di RNA e DNA. C’è stata sorpresa nello scoprire che i due meccanismi operano in sinergia, combinandosi in più di una somma delle loro parti. “Se prendi solo quelle due metà, – ha detto Bratton -, ci sono farmaci disponibili in commercio che possono attaccare una di quelle due vie – ma non uccidono in modo efficace come la nostra molecola, a cui sono uniti insieme sullo stesso corpo “. C’era un problema: l’originale SCH-79797 uccideva le cellule umane e le cellule batteriche a livelli più o meno simili, e come medicina correva il rischio di uccidere il paziente prima di uccidere l’infezione. Il derivato Irresistin-16 lo ha corretto. È quasi 1.000 volte più potente contro i batteri rispetto alle cellule umane, rendendolo un antibiotico promettente. La conferma finale è stata quella di dimostrare di poter usare Irresistin-16 per curare i topi infetti da N. gonorrhoeae. La speranza Il paradigma della freccia avvelenata potrebbe rivoluzionare lo sviluppo di antibiotici, – ha affermato KC Huang, professore di bioingegneria, microbiologia e immunologia all’Università di Stanford- non coinvolto in questa ricerca.”Il particolare, – ha detto Huang-, che non può essere sopravvalutato è che la ricerca antibiotica si è fermata per un periodo di molti decenni. È raro trovare un campo scientifico che sia così ben studiato e tuttavia così bisognoso di una scossa di nuova energia.La freccia avvelenata, -ha aggiunto Huang, ricercatore post dottorato a Princeton dal 2004 al 2008- , la sinergia tra due meccanismi di attacco dei batteri, può fornire esattamente questo”. Questo composto è già così utile da solo, ma anche le persone possono iniziare a progettare nuovi composti ispirati da questo. Questo ha reso il lavoro così eccitante. “In particolare, ciascuno dei due meccanismi – la freccia e il veleno – prende di mira i processi presenti sia nei batteri che nelle cellule dei mammiferi. Il folato è vitale per i mammiferi (motivo per cui alle donne in gravidanza viene detto di assumere acido folico) e, naturalmente, sia i batteri che le cellule dei mammiferi hanno membrane. C’è un’intera classe di obiettivi che è stato in gran parte trascurato perché si pensava: “Non posso bersagliarlo, – ha detto Gitai – perché allora ucciderei anche l’umano'”. “Questo studio afferma, – ha concluso Huang-, che possiamo tornare indietro e rivisitare quelli che pensavamo fossero i limiti del nostro sviluppo per nuovi antibiotici. Da un punto di vista sociale, è fantastico avere nuove speranze per il futuro”.